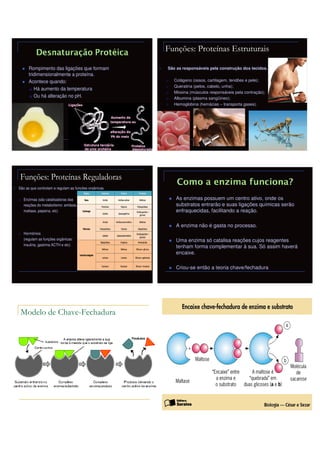
O documento discute o plano semanal sobre proteínas para a 1a série A do Colégio Militar. O plano inclui os subtemas de formação, estrutura e classificação de proteínas, além de suas funções estruturais, regulatórias e de defesa no corpo humano. A seqüência didática inclui discussões sobre alimentos ricos em proteínas, demonstrações da estrutura e ligação de proteínas, e um experimento sobre desnaturação protéica.